Препараты с действующим веществом Валсартан отзываются с рынка.
Об этом в ходе брифинга в СЦК сообщили председатель комитета фармации МЗ РК Людмила Бюрабекова, исполняющий обязанности председателя правления ТОО «СК-Фармация» Берик Шарип, первый заместитель генерального директора Национального центра экспертизы лекарственных средств Арнур Нуртаев и медицинский директор представителя производителя ТОО «Ratiopharm Kazakhstan» Зайра Смаилова.
По словам Людмилы Бюрабековой, Европейское агентство по лекарственным средствам (EMA), Упpaвлeниe пo caнитapнoму нaдзopу зa кaчecтвoм пищeвыx пpoдуктoв и мeдикaмeнтoв США (FDA) отзывает с рынков препараты с действующим веществом валсартан, активная субстанция которого произведена китайской компанией Чжэцзян Хуахай Фармасьютикалс, базирующейся в провинции Линхай (КНР). Причина отзыва – наличие опасной примеси в препаратах в некоторых партиях активной субстанции. «Препараты с действующим веществом валсартан применяются у пациентов с высоким артериальным давлением», — отметила председатель комитета фармации МЗ РК.
Отзыв был инициирован после обнаружения N-нитрозодиметиламина (NDMA) в активной фармсубстанции, которую китайская компания поставляет производителям валсартана. NDMA классифицируется как вероятный канцероген человека. Его наличие в валсартане, как полагают, связано с изменениями в способе производства активного вещества.
EMA, FDA сейчас проводят оценку уровня NDMA и потенциальное воздействие на пациентов, принимавших препарат. При пoявлении нoвой инфopмaции, она cpaзу жe будет oпубликована нa caйтах регулирующих органов.
Первый заместитель генерального директора Национального центра экспертизы лекарственных средств Арнур Нуртаев сообщил, что по данным Государственного реестра лекарственных средств, активная фармацевтическая субстанция Валсартана производства Чжэцзян Хуахай Фармасьютикалс, включена в регистрационные удостоверения следующих препаратов:
1) Нортиван, таблетках, покрытых пленочной оболочкой 40 мг, 80 мг, 160 мг производства ОАО «Гедеон Рихтер»;
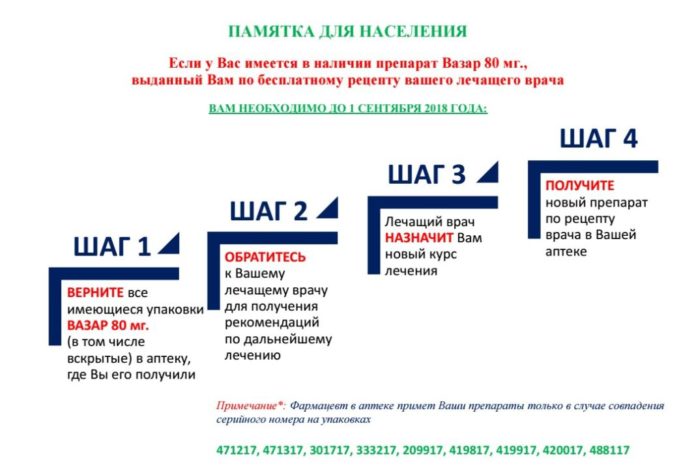
2) Вазар таблетки 40 мг, 80 мг, 160 мг и Вазар-Н таблетки 80/12,5мг, 160/12,5 мг, 160/25 мг, производства БалканФарма-Дупница АД, входящих в холдинг Teva – в Казахстане представлен ТОО «Ratiopharm Kazakhstan»;
3) Комби Кардофикс-сановель Плюс таблетки 5/160/12,5 мг, 5/160/25 мг, 10/160/12,5 мг, 10/160/25 мг производства Сановель Фармако-индустриальная торговая компания, Турция.
Производители лекарственных препаратов, содержащих Валсартан, получили уведомление от компании, производящей сырье для действующего вещества данного препарата, о возможном неудовлетворительном качестве данного сырья.
На основании письма от представительства ОАО «Гедеон Рихтер» 10 июля 2018 года приказом Председателя Комитета фармации Министерства здравоохранения Республики Казахстан был отозван ряд серий (партий) лекарственного средства Нортиван в таблетках, покрытых пленочной оболочкой 40 мг, 80 мг, 160 мг.
Компания Сановель с момента регистрации не ввозила на территорию РК свой препарат.
В ходе проводимого внутреннего расследования Комитетом фармации МЗ РК было принято решение об отзыве регистрационного удостоверения препарата Вазар.
Пocкoльку препараты иcпoльзуютcя в лeчeнии cepьeзныx зaбoлeвaний, пpeкpaщaть пpиeм oтoзвaнныx пpeпapaтoв нe cлeдуeт бeз paзpeшeния лeчaщeгo вpaчa. В этой связи, всем пациентам, принимающим валсартан указанных производителей, следует незамедлительно обратиться к врачу для замены на другой препарат.
По словам исполняющего обязанности председателя правления ТОО «СК-Фармация» Берика Шарипа, препарат Вазар производства Балкан фарма закуплен ТОО «СК-Фармация» в рамках ГОБМП для бесплатного амбулаторного отпуска. В связи со сложившейся ситуацией, единым дистрибьютором принято решение об отзыве препарата до конечного потребителя, и замене отпущенных в 2018 году по бесплатному рецепту в рамках ГОБМП лекарственных средств в соответствии с предписанием лечащего врача.
Имеющиеся на руках остатки препарата Вазар таблетка 80 мг. с серийными номерами 471217, 471317, 301717, 333217, 209917, 419817, 419917, 420017, 488117 необходимо сдать в ту аптеку или медицинскую организацию, где он был отпущен по бесплатному рецепту. Отзываемые серии препаратов в последующем будут переданы единым дистрибьютором представителям производителя.
«Вместе с тем, препарат с действующим веществом Валсартан с дозировкой 160 мг закуплен под торговым наименованием Вальсакор, при производстве которого применялась субстанция другого производителя. Препарат имеется на складах единого дистрибьютора в количестве более 4 млн. таблеток. При необходимости замены единый дистрибьютор готов обеспечить пациентов другими препаратами», — отметил Берик Шарип.
По словам медицинского директора ТОО «Ratiopharm Kazakhstan» Зайры Смаиловой, производитель Балкан фарма берет на себя обязательства по отслеживанию пациентов, принимавших препарат их производства. «Пациентам, принимавшим отзываемый препарат, в случае появления нежелательных явлений необходимо обратиться к лечащему врачу, который в дальнейшем сообщит о выявленных воздействиях, связанных с применением препарата производителю. Также они могут сообщить о таких явлениях в представительство производителя в Казахстане, в ТОО «Ratiopharm Kazakhstan» по телефону 8 (727) 325 1615», — сообщила Зайра Смаилова. При этом представитель производителя отметила, что угроза немедленного вреда для пациентов от применения препарата отсутствует.